Kropki kwantowe
 |
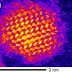
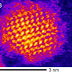
| Zdjęcie STEM CdSe QD [źródło] |
 |
| [źródło] |
 |
| Przykładowa zależność koloru emitowanego światła od rozmiaru kropki kwantowej [źródło] |
 |
| Po lewej kropka kwantowa koloidalna, po prawej epitaksjalna [źródłó] |
Najczęściej używane w syntezie związki
chemiczne to półprzewodniki IV-VI, III-V, II-VI grupy układu okresowego: siarczek
ołowiu PbS, selenek ołowiu PbSe, selenek kadmu CdSe, siarczek kadmu CdS, tellurek
kadmu CdTe, arsenek indu InAs.
Niestety jak widać stabilne układy w swoim
składzie zawierają toksyczne metale ciężkie kadm i ołów, alternatywą dla nich
są odpowiednio zpasywowane kropki z fosforku indu InP i siarczku indu miedzi CuInS.
Aczkolwiek aktualny zakaz stosowania metali ciężkich w elektronice nie obejmuje
kropek kwantowych wykonanych z kadmu [źródło]. Decyzja Parlamentu Europejskiego wynika z
oszczędności energetycznej urządzeń na kropkach kwantowych, której pozytywny
wpływ na środowisko przewyższa negatywne skutki związane z toksycznością
(ciekawe co na to pracownicy niemodernizowanych azjatyckich fabryk i wysypisk?).
Dlaczego te kilka-naście-dziesiąt uporządkowanych atomów w ogóle świeci? Cząsteczka półprzewodnika zawiera w sobie określoną ilość
elektronów. Elektrony i ich energię opisuje się za pomocą modelu pasmowego.
Elektrony
‘normalnie’ mają energię z zakresu pasma
walencyjnego, jednak można im trochę energii dodać np. świecąc na nie
światłem. Przechodzą wtedy na wyższy poziom energetyczny przewodnictwa. Ten stan nie jest dla
nich jednak naturalny i dążą do tego żeby nadmiaru energii się pozbyć. A
pozbywają się jej w postaci wypromieniowanego fotonu (światła).
Proces
taki to FLUORESCENCJA. Należy przy tym zauważyć, że wypromieniowana jest zawsze
energia mniejsza niż energia pochłonięta, ponieważ podczas relaksacji część
energii rozprasza się termicznie i bezpromieniście (przesunięcie Stokesa). Wypada też sobie przypomnieć, że
co oznacza, że im większa energia tym
krótsza fala. Czyli
krótsza fala (o dużej energii)
powoduje wypromieniowanie dłuższej fali (o
mniejszej energii).
 |
| [źródło] |
 |
| [źródło] |
Żeby
wytłumaczyć zmienianie się emitowanych kolorów w zależności od rozmiaru musimy sięgnąć
po fizykę kwantową. W wyniku ograniczenia kwantowego (ang. quantum confinement) wraz ze zwiększaniem ilości atomów w kropce, kolor
emitowanego światła przesuwa się w kierunku czerwieni. Ograniczenie to wynika ze
zmniejszającej bądź zwiększającej się objętości, w której elektron może uciec
od swojej dziury (średnica kropki kwantowej musi być jednak mniejsza niż 2 razy promień atomu Bohra). Stan, w którym elektron nie może „odpłynąć” za daleko i jest elektrostatycznie
związany z dziurą nazywamy ekscytonem. Kiedy zmniejszamy rozmiar kropki elektron
potrzebuje więcej energii na utworzenie ekscytonu, czyli wyskoczenie z poziomu
walencyjnego do przewodnictwa (pamiętamy z akapitu wyżej większa energia to krótsza fala).
 |
| [źródło] |
Typowa
kropka kwantowa to nie jest jedynie zlepek kilku atomów półprzewodnika (jak
koloidalna kropka pokazana na rys. 4). Przemysłowo zwiększenie wydajności kropki osiąga się
izolując ją w powłoce (ang. shell) z półprzewodnika o
większej przerwie energetycznej, bądź pokrywając ją związkami organicznymi.
Po co ta
osłonka? Oprócz chronienia kropki przed czynnikami środowiskowymi i
fotooksydacją, zmniejsza się prawdopodobieństwo przejść nieradiacyjnych (rekombinacja
elektronu i dziury, w którym nie jest emitowane światło) takich jak emisja
fononu i rekombinacja Augera (Ożę :)).
Nieosłonięta powierzchnia
kryształu naraża całą kropkę na straty ponieważ to na niej zmniejsza się
regularność sieci krystalicznej. Z powodu powierzchniowych niekompletnych wiązań (atom
nie ma się do czego przyłączyć) powstają niezpasywowane tudzież dyndające
orbitale (ang. dangling orbitals) z
nadmiarem lub niedomiarem ładunku. Jeżeli energia tych zewnętrznych orbitali
mieści się w przedziale energii pasma wzbronionego wnętrza kropki, to te
orbitale stają się miejscami pułapkowania nośników ładunku – elektronów i dziur,
krótko mówiąc nośniki przyczepiają się do wolnych wiązań, więc w centrum kropki
jest mniej ekscytonów gotowych do rekombinacji promienistej. W roztworze
koloidalnym otaczano jądro półprzewodnika grupami organicznymi np. tlenkiem
trietylofosforu TOPO (ang. trioctylphosphine oxide).
 |
| [źródło] |
Nie
radzi sobie on jednak w stu procentach z wystającymi orbitalami, a powód jest
dosyć błahy. Ligandy zajmują dużo miejsca w przestrzeni i mogą się do siebie
zbliżać tylko na określoną odległość (bez pokrywania), ponieważ przekraczając
ją zaczynają się odpychać (efekt steryczny), stąd niektóre wiszące orbitale
dalej zostają wolne – ligandy nie mogą ściśle, gęsto porosnąć kulki
półprzewodnika.
Powłoczka
z półprzewodnika natomiast pokrywa całą powierzchnię centrum. Nośniki ładunku
mają mniejsze prawdopodobieństwo zostać zpułapkowane, a tym samym mają więcej
czasu i szansy na natrafienie na siebie i zrekombinowanie promieniste.
Przykład
takiej konfiguracji stanowi CdSe/CdS.
 |
| [źródło] |
Największą
popularność kropki kwantowe zdobyły za sprawą wykorzystania ich w celu
polepszenia jakości wyświetlanego obrazu w telewizorach LCD. Technologia,
ponieważ nie jest najwydajniejsza na rynku, brzmiąc egzotycznie i hightechowo
była zabiegiem po części marketingowym. Jakie jednak niewątpliwe ulepszenia ze
sobą niosła? Używając kropek osiąga się lepszą jaskrawość i ostrość barw a za
tym rozpiętość tonalną (duża różnica między jasnym a ciemnym miejscem na
obrazie – duża szczytowa luminescencja). Pozwalają też na bardzo precyzyjne
odtwarzanie barw tak, że zgadzają się z zamysłem producenta filmu, pokrywając
całkowicie DCI-P3, czyli gamę kolorów stosowaną przez amerykański przemysł
filmowy jako standard dla wyświetlania filmów cyfrowych.
 |
| [źródło] |

Technicznie istnieje kilka sposobów implementowania kropki w wyświetlacz. Mnie najbardziej zaciekawiło, że w ekranie bardzo rzadko używane są niebieskie kropki. Są one zbyt niestabilne i trudne do wytworzenia. Zamiast wyświetlać niebieską kropkę stosuje się doświetlanie niebieskim ledowym panelem pustych pikseli.
 |
| [źródło] |
Po więcej informacji na ten temat odsyłam na stronę Samsunga, który sworzył bardzo fajne centrum learningowe [tutaj].
Na koniec ciekawostka historyczna :)
Nazwa
kropka kwantowa pojawiła się pierwszy raz w publikacji z 1986 roku „Spatial quantization in GaAs–AlGaAs multiple
quantum dots”, M. A. Reed, R. T. Bate, K. Bradshaw, W. M. Duncan, W. R.
Frensley, J. W. Lee, and H. D. Shih [źródło] ale już we wczesnych latach dwudziestych, kropki CdS i CdSe nieświadomie używane były w
barwieniu krzemowego szkła i witraży.
Źródła i literatura uzupełniająca:
- Bera, Debasis et al. “Quantum Dots and Their Multimodal Applications: A Review.” Materials 3.4 (2010): 2260–2345. PMC. Web. 17 Sept. 2018
- Semiconductor Nanocrystals: Structure, Properties, and Band Gap Engineering, Andrew M. Smith and Shuming Nie, Accounts of Chemical Research 2010 43 (2), 190-200
- DYREKTYWA DELEGOWANA KOMISJI (UE) z dnia 7.8.2017 r. zmieniająca, w celu dostosowania do postępu technicznego, załącznik III do dyrektywy Parlamentu Europejskiego i Rady 2011/65/UE w odniesieniu do wyłączenia dla kadmu w diodach elektroluminescencyjnych (LED) dokonujących konwersji długości fali światła w systemach wyświetlania.
- https://en.wikipedia.org/wiki/Core%E2%80%93shell_semiconductor_nanocrystal
- https://pid.samsungdisplay.com/en/learning-center/white-papers/quantum-dot-technology




Leave a Comment